نظریه ی حالت گذار
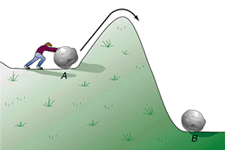
نظریه ی حالت گذار پیشنهاد می کند هنگامی که مولکول های واکنش دهنده به نزدیکی همدیگر می رسند، به طور آنی در حالتی با پایداری کم تر از پایداری حالت واکنش دهنده ها و محصولات خواهند بود.
در نظریه ی حالت گذار، مکانیسم اندرکنش واکنش دهنده ها مطرح نیست؛ معیار مهم آن است که مولکول های واکنش دهنده، انرژی کافی برای غلبه بر سد پتانسیل انرژی (انرژی فعال سازی) داشته باشند تا واکنش دهند.
در این حالت با پایداری کم تر، اتمها خود را از نو آرایش می دهند، پیوندهای اصلی ضعیف می شوند و پیوندهای جدید اندکی تشکیل می شوند.
انرژی پتانسیل سیستم در این نقطه افزایش می یابد؛ زیرا:
· مولکول های واکنش دهند هی در حال واکنش، باید به نیروهای دافعه ی متقابل بین الکترون های لایه ی بیرونی تر اتم های سازنده ی خود غلبه کنند.
· اتم ها باید هنگام شکسته شدن پیوندهایشان از هم جدا شوند.
برای یک واکنش دو مولکولی، حالت گذار هنگامی تشکیل می شود که پیوندهای مولکول های قدیمی، ضعیف می شوند و پیوندهای جدید شروع به شکل گیری می کنند یا این که ابتدا پیوندهای قدیمی می شکنند تا حالت گذار را شکل دهند و بعد از آن پیوندهای تازه تشکیل می شوند.
در مثال زیر، حالت گذار اتفاق می افتد:
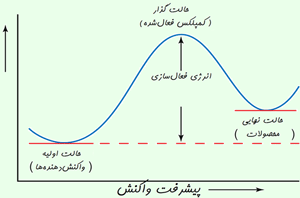
رسیدن به حالت گذار، انرژی زیادی لازم دارد؛ بنابراین این حالت، مادهای با انرژی زیاد به وجود میآید. این افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.
آرایش اتمها در بیشینهی این سد پتانسیل، کمپلکس فعال یا حالت گذار نامیده میشود و یک حالت واسطهی گذرا بین واکنشدهندهها و محصولات است.
· حالت گذار یا کمپلکس فعال شده، یک حالت ترکیبی ناپایدار گذرای مولکولهای واکنشدهنده است که در یک بیشینهی انرژی پتانسیل اتفاق میافتد.
این ترکیب هم می تواند در جهت تولید محصولات به پیش رود و هم به سمت واکنش دهندههای تغییر نیافته برگردد.
· تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل به انرژی فعال سازی برمی گردد.
حرکت واکنش از روی بیشینهی انرژی پتانسیل اغلب با دیاگرام هماهنگ واکنش نشان داده می شود.
افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.

شکلهای زیر، نظریهی حالت گذار را با اشاره به واکنش بین هیدروژن و ید برای تولید یدید هیدروژن نشان میدهد:
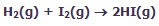
در این فرایند، مولکول های واکنشدهنده به همدیگر نزدیک میشوند و زمانی که آن ها در حین متعادلسازی واکنش برای حالت گذار یا کمپلکس فعالشده به پیش میروند:

پیوندهای اصلی ضعیف میشوند.

پیوندهای جدید نسبتاً تشکیل میشوند.
در این شکل، واکنش در حهت تولید محصول پیشرفت میکند. این شکلها را به دقت نگاه کنید تا ضعیف شدن پیوندهای اصلی و تشکیل پیوندهای جدید را بعد از تولید محصولات ببینید:
همان طور که دما افزایش پیدا می کند، سهم اجزای واکنش دهندهای که می توانند به بیشینه ی انرژی پتانسیل برسند، افزایش پیدا می کند؛ افزایش تعداد مولکول ها ی محصول که در هر ثانیه تشکیل می شوند، آهنگ واکنش را افزایش می دهد.

نکات کلیدی:
 افزایش دمایی مانند ١٠ K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند.
افزایش دمایی مانند ١٠ K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند.
نظریه ی برخورد بر پایه ی انرژی جنبشی است و فرض میکند که ذرات باید دارای دو شرط جهت مناسب و انرژی جنبشی کافی باشند تا واکنش دهنده ها به محصول تبدیل شوند.

کم ترین انرژی جنبشی لازم برای یک برخورد توسط مولکول های واکنش دهنده برای تشکیل محصولات، انرژی فعال سازی (Ea) نامیده میشود.

نسبت مولکول های واکنش دهنده ای که با انرژی جنبشی مساوی با انرژی فعال سازی واکنش می دهند، با افزایش دما زیاد می شود.

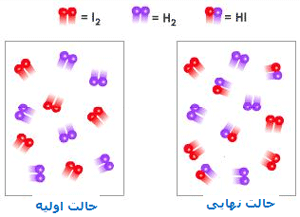
نظریه ی حالت گذار پیشنهاد می کند که هنگام نزدیک شدن مولکول های واکنش دهنده، یک کمپلکس فعال شده ی گذرا (حالت گذار) در بیشینه ی انرژی پتانسیل تشکیل می شود.

در نظریه ی حالت گذار، انرژی فعال سازی، تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل است.

در کمپلکس فعالشده، پیوندهای اصلی ضعیف شده و پیوندهای جدید نسبتاً تشکیل میشوند. کمپلکس فعالشده ممکن است در جهت تولید محصولات به پیش رود و یا به سمت واکنشدهندهها برگردد.

زمانی که دما افزایش پیدا می کند، نسبت بزرگ تری از مولکول های واکنش دهنده می تواند به بیشینه ی انرژی پتانسیل رسیده و کمپلکس فعال شده تشکیل دهند. بنابراین تعداد مولکول های محصول تشکیل شده در هر ثانیه افزایش پیدا می کند.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

